-
Le virus SARS-Cov-2 (Covid-19) apparaît officiellement en Chine en décembre 2019. Quoique membre de la famille connue des coronavirus, il s’agit d’un nouveau venu dont les caractéristiques virologiques, épidémiologiques, cliniques et pronostiques sont progressivement appréhendées. A chaque étape, nous avons assisté à une succession de nouvelles trop rapidement publiées par des médias d’information, discutées sans filtre par des médecins pas toujours compétents dans ce domaine spécifique, relayées par les milieux sociaux, souvent infirmées après quelques semaines, et alors sources de rumeurs angoissantes.
Au cours du mois d’avril 2020, des services pédiatriques de Lombardie(1), épicentre de la pandémie de Covid-19 en Europe, ont publié des alertes à propos d’enfants qui auraient développé une « maladie de Kawasaki » concomitamment à une infection par la Covid-19 ! Ces signalements ont été rapidement confirmés à Paris, y compris chez de très jeunes nourrissons <3mois(2,3), Londres(3) et Washington(5).
Il convient donc de s’attacher aux faits et de répondre à des questions légitimes :
- Comment définir la maladie de Kawasaki ? Cette maladie est-elle grave ?
- Y a t’il une relation entre la maladie de Kawasaki et la pandémie de Covid-19 ?
- Quels conseils donner aux parents évidemment inquiets et à leurs entourages ?
A) La maladie de Kawasaki(6).
Il s’agit d’une vascularite multisystémique aigüe pouvant atteindre toutes les artères de petits et moyens calibres, mais avant tout les artères coronaires. Elle peut être diagnostiquée à tout âge de l’enfance et de l’adolescence, principalement les nourrissons et jeunes enfants, majoritairement des garçons, âgés de moins de 5 ans (80% des cas), rarement avant 3 mois ce qui conduit à supposer l’existence d’une protection immunologique maternelle.
Elle est devenue la première cause des cardiopathies acquises de l’enfance dans les pays développés et la deuxième vascularite après le purpura rhumatoïde.
Le diagnostic est envisagé à partir de signes cliniques apparus brutalement en atmosphère inflammatoire chez des enfants le plus souvent dépourvus de comorbidité mais une comorbidité (toute maladie cardiaque ou respiratoire ou rénale, toute maladie chronique considérée comme grave comme le diabète ou l’hypertension artérielle, tout déficit immunitaire, tout état morbide comme le diabète … ) aggrave évidemment le pronostic.
On ne connaît toujours pas la cause : probablement infectieuse bien qu’à ce jour aucun agent n’ait été spécifiquement identifié. Cette hypothèse peut être surtout retenue du fait de sa saisonnalité (fin d’hiver et printemps), de ses caractéristiques épidémiologiques, de signes lympho-cutanéo-muqueux évocateurs de maladies infectieuses.
L’importance des signes biologiques d’inflammation oriente vers une suractivation du système immunitaire, comportant la description de véritables « orages cytokiniques » induits par une infection (comme cela a été décrit en cas d’infections par virus respiratoires ou entérovirus) et conférant une logique ayant conduit à la prescription de traitements anti-inflammatoires, immunologiques et parfois anticoagulants qui ont prouvé leur efficacité.
Quoique décrite en 1967 au Japon (avec un premier cas en France publié par G.Brévière en 1979)(7), cette maladie reste mystérieuse à bien des égards …
Rare en Europe et aux USA (10 à 20/100000 selon les pays), elle est quinze à vingt fois plus fréquente au Japon et dans d’autres pays d’Extrême-Orient, ce qui a conduit à supposer l’influence de facteurs environnementaux, géographiques(8) mais aussi génétiques. Plusieurs gènes impliqués dans la réponse immunitaire des populations japonaises et occidentales ont été identifiés dont deux gènes principaux qui permettent d’approcher l’explication du mécanisme d’action des immunoglobulines encore partiellement compris et de l’implication de l’immunité innée : il s’agit de FCGR2A codant la région du récepteur II de la fraction FC de la gammaglobuline(9) et de ITPKC codant la régulation de l’activation des lymphocytes T(10).
Des critères cliniques conduisent à l’évocation du diagnostic(11, 12) en l’absence de test pathognomonique.
Une fièvre avec photophobie, apparue brutalement, rebelles aux traitements habituels et il est convenu de penser à la maladie de Kawasaki devant tout enfant chez lequel une fièvre persiste plus de quatre jours (J1 : début de la fièvre).
Des adénopathies cervicales non purulentes et résistantes aux antibiotiques.Des signes cutanés : exanthème caractéristique morbilliforme ou ressemblant à la scarlatine, atteignant tronc, membres, visage et régions périnéales , les paumes des mains et plantes des pieds avec, surtout, des œdèmes des dos des mains et des pieds. Une desquamation palmaire, plantaire et péri-unguéale est observée au cours de l’évolution.
Des signes muqueux : conjonctivite bilatérale, chéilite avec sécheresse des lèvres fissurées, énanthème buccal et pharyngite.
Des signes non spécifiques : des signes digestifs (douleurs, diarrhée, vomissements), des arthralgies, des signes neurologiques et méningés, une insuffisance hépatique et une cytolyse, des pneumopathies et difficultés respiratoires, un collapsus. Ces signes, même dissociés mais en atmosphère fébrile prolongée et sans contexte chirurgical, sont évocateurs. On conçoit la difficulté du diagnostic surtout s’ils sont dégradés, isolés, faisant alors parler de « forme incomplète de maladie de Kawasaki ».
Le diagnostic de forme complète de maladie de Kawasaki doit donc être envisagé en cas d’état fébrile rebelle après quatre jours de traitement si au moins quatre de ces signes sont observés.
Les examens de laboratoire confirment le caractère inflammatoire de la maladie. Avec des signes habituels (CRP>30mg/L, VS>40mm à la première heure), hyperleucocytose avec une mention spéciale pour la thrombocytose particulière par l’importance de son niveau souvent >800000/mm3 si fréquente après la première semaine.
Depuis 2004, on décrit des formes partielles, dites « incomplètes »(10). Les enfants sont un peu plus âgés (6-8 ans). On ne doit certainement pas hésiter d’envisager une forme incomplète dès que trois voire seulement deux des signes cliniques et d’inflammation précédemment énoncés sont présents chez un enfant fébrile depuis cinq jours ( … et même quatre !) malgré tous les traitements mis en œuvre. Le diagnostic de ces formes dégradées et incomplètes est souvent difficile(12) ce qui explique la possibilité des retards de diagnostic.
Or, l’hypothèse d’un diagnostic de maladie de Kawasaki conduit directement à redouter une atteinte cardiaque, à la fois signe et complication de cette maladie même dans des formes cliniquement dégradées. Prescrire le plus tôt possible les traitements recommandés a l’avantage de prévenir une atteinte cardiaque avant sa survenue ou de la traiter dans de meilleures conditions si l’enfant en souffre au moment du diagnostic.
L’électrocardiogramme peut mettre en évidence des troubles diffus non spécifiques de la repolarisation mais aussi, dans 10% des cas, des troubles de la conduction auriculoventriculaires généralement du 1er degré.
L’échocardiographie-doppler est, comme chacun sait, un examen non invasif particulièrement adapté à l’enfance. Il est partout disponible. Au moindre doute de maladie de Kawasaki, que la forme clinique soit complète ou incomplète, les examens ultrasonores qui étayeront le diagnostic doivent être demandés en urgence(10,11).
On contrôle les artères coronaires dont l’atteinte peut survenir dans les trois semaines suivant le début de la maladie. (Figure 1). Les données seront interprétées en fonction de courbes de référence disponibles(10).
Ces artères peuvent être dilatées avec une paroi souvent hyperéchogène et épaissie et parfois présence d’anévrysmes (25% des formes non traitées).
Ces anévrysmes peuvent être uniques ou multiples et intéresser l’une des deux artères coronaires ou les deux. De dimension variable < 1-2mm à > 8mm (on parle alors d’anévrysme géant), ils peuvent être uniques ou multiples, parfois en chapelet. (12, 13).
Une dysfonction ventriculaire gauche peut être secondaire à une thrombose coronaire et une ischémie, mais à la phase aiguë, il s’agit surtout d’une myocardite, ce qui n’a rien de surprenant dans le cadre de cette maladie inflammatoire et probablement infectieuse.
L’échocardiographie peut également dévoiler une atteinte valvulaire et péricardique. Elle permet de suivre l’évolution de la fonction cardiaque et les pressions pulmonaires en cas de pneumopathie et d’insuffisance respiratoire.
Le scanner coronaire analyse l’atteinte mycardique et visualise l’ensemble du réseau coronaire et aortique. Toutes les artères moyennes peuvent être atteintes et le scanner peut utilement compléter l’échocardiographie pour faire le bilan de la maladie même si le pronostic dépend réellement de l’état coronaire.
Le traitement(11,12).
Une limitation et une régression des anomalies coronaires sont possibles. C’est surtout vrai si le traitement intervient dans les 10 premiers jours de la maladie (J1 du début de la fièvre). La précocité du diagnostic et de la mise en œuvre du traitement est ainsi la clé de son efficacité et de la prévention atteintes coronaires et des complications cardiologiques possibles à long terme.Il s’agit donc d’un impératif apparentant la maladie de Kawasaki à une urgence médicale.
On dispose en effet de traitements efficaces pour combattre l’inflammation mais aussi de prévenir la survenue des signes coronaires (<5% des cas traités à temps vs 25%).
Le plus rapidement possible - dans la première semaine suivant le début de la maladie (J1 de la fièvre) - l’enfant doit bénéficier de l’administration intraveineuse d’immunoglobulines (IgG) (2g/kg) Une résistance pourra conduire à indiquer une deuxième administration. On adjoint l’acide acétylsalicylique (80-100mg/kg) en se rappelant que l’ibuprofène est à éviter.
Dans 85 % des cas, un traitement précoce aura pour résultat de diminuer rapidement la fièvre et les signes inflammatoires.
En cas d’inefficacité, une anémie hémolytique peut survenir (15%) on s’orientera vers d’autres voies. Il s’agit de corticoïdes (3mg/kg/24h pendant trois jours ce qui à l’origine paraissait « contre-intuitif » mais dont la logique est apparue depuis la description du « syndrome de libération de la cytokine ») et également des inhibiteurs des TNF alpha ou anticorps monoclonaux (infliximab).
En cas d’atteinte coronaire précoce, l’enfant aura toutes les chances de récupérer un réseau coronaire normal si le traitement est commencé dans les sept premiers jours. Ces chances seront d’autant plus grandes qu’il s’agira de simples dilatations des artères ou d’anévrysmes de petite taille (<2 mm).
L’observation d’un réseau coronaire normal autorisera l’arrêt de l’acide acétylsalicylique après six semaines. Plusieurs années d’astreinte à des traitements prolongés, des limitations sportives, des incertitudes pronostiques cardiologiques seront ainsi évitées et protégeront ces enfants contre des complications liées aux thromboses et au remodelage des artères.
Si le traitement a été débuté au-delà du dixième jour, le risque coronaire est augmenté et la chance d’obtenir une régression des anévrysmes « moyens » ou d’anévrysmes « géants « (>8mm), est plus aléatoire et plus retardée.
Si la régression est nette mais incomplète, les anticoagulants hépariniques de la phase aigüe seront relayés par une association « acide acétylsalicylique–clopidrogel ». Ceci est évidemment positif quand on connaît les difficultés du maniement des prescriptions prolongées d’anticoagulants et d’antivitamines K chez les jeunes enfants.
En cas de persistance d’anévrysmes coronaires larges (>4mm) voire géants (> 8mm), les anticoagulants seront maintenus. Ils seront éventuellement associés à des traitements préventifs par béta-bloqueurs ou inhibiteurs de l’enzyme de conversion. Des indications de revascularisation chirurgicale chez de jeunes adultes seront parfois aussi indispensables.
Maladie de Kawasaki et Covid-19
Il ressort de ce qui précède que la maladie de Kawasaki est une maladie grave. Il est urgent d’y penser, surtout en période d’épidémie ou d’endémie infectieuse, comme c’est le cas depuis 2019 et l’apparition et la généralisation de la COVID-19.
On comprend que la nouvelle d’une multiplication de cas dans des zones géographiques frappées par la pandémie en cours ait suscité les préoccupations des milieux pédiatriques.
Un lien direct semble effectivement exister entre la maladie de Kawasaki et la Covid-19 :
- un lien entre la maladie de Kawasaki et une épidémie par coronavirus a déjà été envisagé dès 2005 (15).
- En période de pandémie virale virulente, il est extrêmement préoccupant de retrouver un nombre d’enfants souffrant de maladie « type-Kawasaki » nettement supérieur au nombre attendu. Nos collègues italiens estiment que la fréquence de maladie de Kawasaki a été 30 fois supérieure à la fréquence attendue.
- C’est également ce qui a été observé à Paris puisque le professeur Damien Bonnet (Necker) a fait état de nombreux cas sur une période de moins d’un mois alors que, en situation habituelle, la fréquence des diagnostics de maladies de Kawasaki n’excède pas un cas par mois.
- De plus, comme dans la maladie de Kawasaki, on observe en France une prédisposition ethnique africaine et antillaise et aux Etats-Unis, hispanique et afro-américaine.
- Une étude collaborative française et suisse a été publiée sous l’égide du Professeur Damien Bonnet (Necker-Paris)(3). Elle concerne 35 enfants infectés par le Covid-19 (positivités bactériologiques chez 88%) ayant développé une atteinte cardiaque avec myocardite et dysfonction ventriculaire gauche significative.
Tous les enfants de ce groupe, plus âgés (7 ans) que dans les cadre de la maladie de Kawasaki habituelle, ont survécu y compris ceux qui présentaient des signes de haute gravité et ayant dû être traités au moyen de mesures de réanimation extrêmement lourdes puisqu’une oxygénation par membrane extracorporelle (ECMO) a été nécessaire chez 28% d’entre eux.
En outre, la fonction ventriculaire gauche restait diminuée à la sortie de l’unité de soins intensifs chez 10/35 enfants. Cette relation directe a été de même confirmée en Italie, au niveau de l’épicentre de la pandémie en Europe. - Il y a une claire notion d’épidémiologie de maladie infectieuse puisque 70% des enfants dont il est question ont eu un contact avec des personnes de leur entourage diagnostiquées comme positives par PCR.
Cependant, des différences notables ont conduit à individualiser une entité particulière(17) comportant un âge moyen des patients COVID de 7 ans donc plus élevé que les patients Kawasaki classiques, des profils biologiques différents, des incertitudes sur les risques d’évolution de déficience prolongée notamment pulmonaire ou immunologique. Une grande différence est la notion d’une étiologie infectieuse des MISC clairement identifiée avec son corollaire de possibilité de vaccination qui a l’énorme avantage de mettre les patients à l’abri des formes graves. Largement approuvée et favorisée en cas de comorbidités, largement acceptée chez les jeunes âgés de plus de 12 ans, elle reste discutée à ce jour chez les enfants âgés de 6 à 11 ans sans comorbidité. Promue aux Etats-Unis y compris pour cette dernière catégorie du fait de l’importante mortalité (plus de1000 décès en décembre 2021), acceptée en Israël, on note une réticence en France en l’absence de facteurs de risques et où les conditions de la prise en charge pédiatrique sont bien différentes.
En conclusion :
En dépit des critères diagnostiques, des risques, des conduites pratiques communs, deux entités sont actuellement décrites, à savoir la maladie de Kawasaki traditionnelle et le syndrome multisystémique inflammatoire chez l’enfant (Multisystemic Inflammatory Syndrome in Children dit « MIS-C ») par infection par la Covid-19. Du 2 mars 2020 au 30 décembre 2021, Santé Publique France rapporte 826 cas de MIS-C 80% en rapport direct avec une infection par la Covid 19.(18)
On doit absolument être informé de cette association pour être en mesure de prescrire rapidement les traitements préconisés, sans perte de temps et sans perte de chance. C’est d‘autant plus vrai que le profil d’une seconde vague pourrait différer du fait d’une modification du virus, d’une association de plusieurs agents infectieux(16) ou d’une modification du profil clinique de la maladie comme cela a été le cas lors de la pandémie de « grippe de Hong-Kong (H3N2) » de 1968-1970 où des patients plus jeunes ont été plus gravement affectés lors de la « deuxième vague ».
En conséquence, un principe est à retenir par toutes les personnes soignantes prenant en charge des enfants à fortiori en période de pandémie SARS-Cov-2 :
- la maladie de Kawasaki doit être considérée comme une urgence médicale. C’est aussi le cas de MISC/PIMS
- une fièvre rebelle de plus de quatre jours accompagnée d’un quelconque signe doit faire penser à ce diagnostic.
- ceci doit orienter le patient, en urgence, vers une consultation pédiatrique spécialisée, une consultation cardiologique avec échocardiographie-doppler avant qu’une discussion pluridisciplinaire puisse valider le diagnostic de maladie de Kawasaki ou de MISC-C /PIMS et initier le traitement..
Bibliographie
1) L. Verdoni et Coll : An outbreak of severe Kawasaki-like disease at the Italian epicentre of the SARS-CoV-2 epidemic: an observational cohort study. The Lancet 2020 (May 13) : 396
2) N.Nathan et Coll. Atypical presentation of COVID-19 in young infants . Lancet 2020 ;395 : 1481
3) Z.Belhadjer et Coll. : Acute heart failure in multisystem inflammatory syndrome in children (MIS-C) in the context of global SARS-CoV-2 pandemic Circulation, 2020 (May 19) ; 141
4) S. Rhippagen et Coll. Hyperinflammatory schock in children suffering from Covid-19. Lancet ;395 :1607
5) RL. DeBiasi . Severe COVID-19 in Children and Young Adults in the Washington, DC Metropolitan Region . J.Pediatr. 2020 (May 13) ; 220
6) R. Cimaz et Coll. La maladie de Kawasaki. Rev Prat et Orphanet 2007 ; 57 : 1985-1988
7) GM Bréviere, « Le syndrome adeno-cutanéo-muqueux avec atteinte pulmonaire. », Archives françaises de Pédiatrie, 1979 ; 36 : 182-187
8) JC Burns et coll. Seasonality and Temporal Clustering of Kawasaki Syndrome .Epidemiology 2005 ; 16 : 220-225.
9) Khor C et col. . Genome-wide association study identifies FCGR2A as a susceptibility locus for Kawasaki disease. Nat Genet 2011;43:1241—1246.
10) Onouchi Y, et coll. ITPKC functional polymorphism associated with Kawasaki disease susceptibility and formation of coronary artery aneurysms. Nat Genet 2008;40:35—42.
11) Newburger et coll. Diagnosis, treatment, and long-term management ofKawasaki disease: a statement for health professionals from the Committee on Rheumatic Fever, Endocarditis and Kawasaki Disease, Council on Cardiovascular Disease in the Young, Circulation 2004;110:2747—71.
12) McCrindle et Col. Diagnosis treatment and long-term management of Kawasaki disease. Circulation ; 2017 , 135 : 927-99
13) A. Harahsheh. Missed or delayed diagnosis of Kawasaki disease during the 2019 coronarovirus disease (Covid-19) pandemic. J.Pediatr. 2020 ( April 23th)
14) K.Friedman et Coll . Coronary Artery Aneurysms in Kawasaki Disease: Risk Factors for Progressive Disease and Adverse Cardiac Events in the US Population JAHA Sept 2016 Vol5-Nb .
15) F.Esper et Coll. Association between a Novel Human Coronavirus and Kawasaki Disease J. of Infectious Diseases 2005 ; 191 : 499-502
16) E.Payan et Coll : SARS-Cov-2 and influenza virus coinfection. The Lancet 2020 (May 05) : 395 : 1587
17) MK Siebach et al. Covid 19 in Childhood : Transmission, clinical presentation, complications and risk factors - Pediatric Pulmonology 2021 ; 56 :1342-1346
18) Surveillance des cas de Syndrome Inflammatoire multisystémique Pédiatrique-Santé Publique France Bilan au 30 décembre 2021
FIGURES: Atteintes coronaires
Figures 1 a et b. Echocardiographie
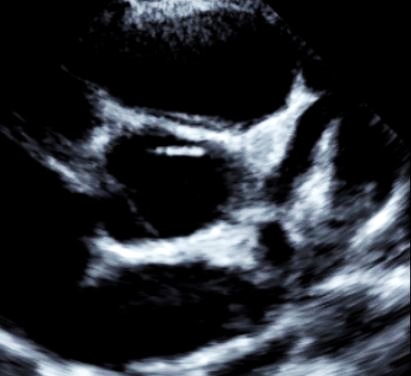
a-Echocardiographie : dilatation du tronc commun coronaire gauche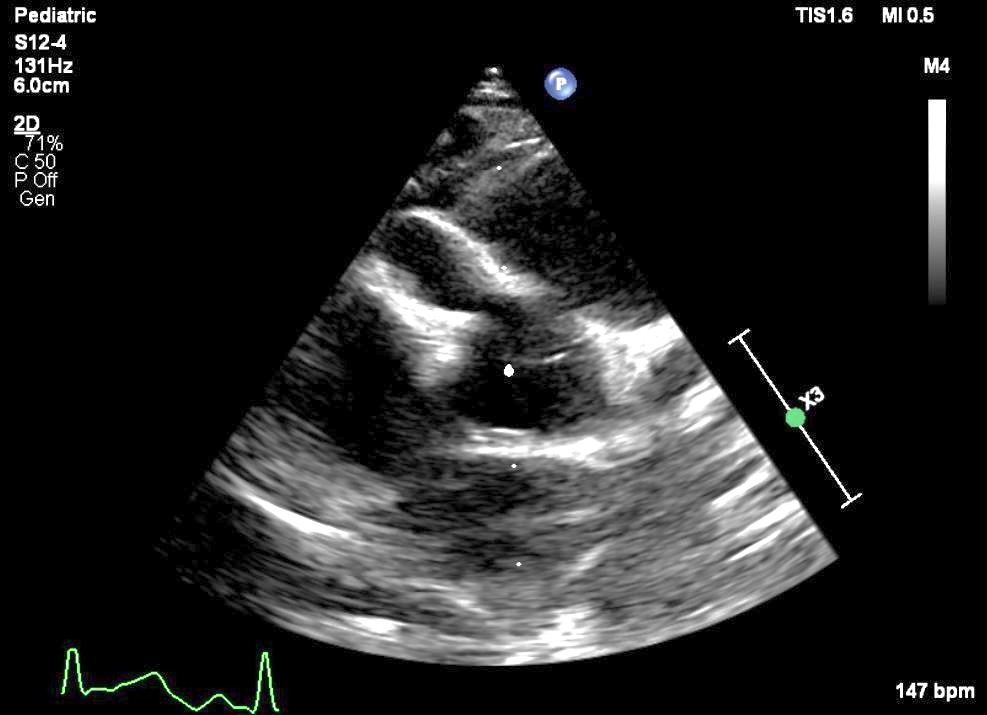
b-Echocardiographie : Anévrysmes coronaires droits et gauches proximaux
Figures 2 : SCANNER
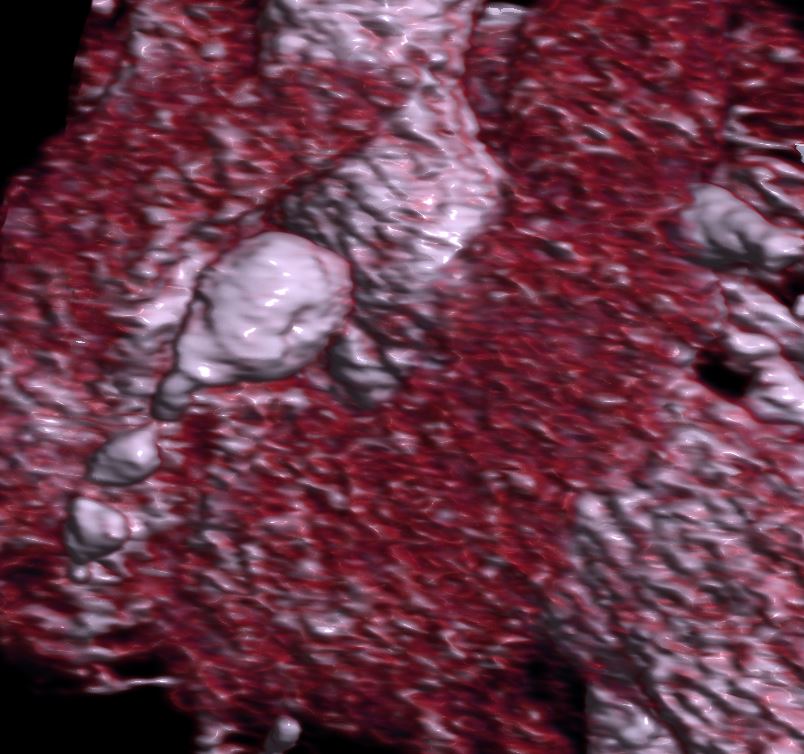
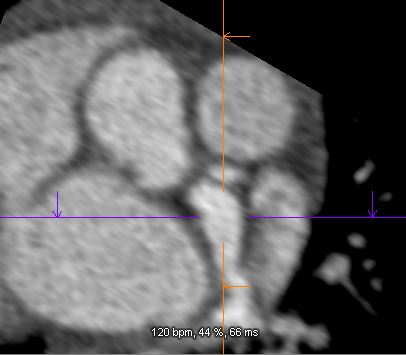
Figure 2 : Scanner coronaires . Anévrysmes
Dr Max Godfrey ; Shaare Zedek Medical Center Jerusalem-Israël
-