-
LA FURINE
La furine est une protéase à sérine qui catalyse le clivage d'un polypeptide au niveau typiquement d'une séquence basique de la forme –Arg–Xaa–(Arg/Lys)–Arg- - où Xaa représente un résidu d'acide α-aminé protéinogèneα-aminé protéinogène quelconque.
Elle intervient pour finaliser la synthèse de certaines protéines en leur conférant leur structure fonctionnelle (albumine, facteur de Willebrand, Insuline etc). Elle a aussi un rôle dans la régulation de la matrice cartilagineuse.
On la trouve dans de nombreuses cellules de l’organisme ainsi qu’à leur surface.
LIAISON DU VIRUS A LA CELLULE
Le coronavirus se lie à la cellule qu’il va infecter en appariant sa protéine spike ou spicule à un récepteur situé sur la membrane cellulaire.
Le sars-cov 2 a une affinité pour un récepteur particulier appelé site ACE2.
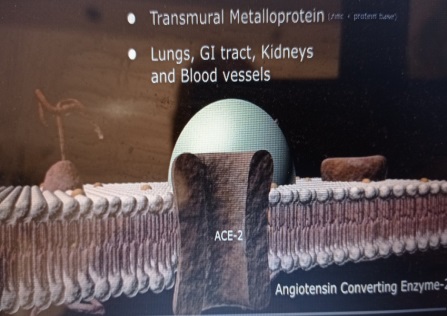 Ce site ACE2 est celui qu’utilise l’enzyme de conversion de l’angiotensine 2, laquelle joue un rôle essentiel dans la régulation du système rénine-angiotensine-aldostérone, dont le rôle principal est le contrôle de la tension artérielle.
Ce site ACE2 est celui qu’utilise l’enzyme de conversion de l’angiotensine 2, laquelle joue un rôle essentiel dans la régulation du système rénine-angiotensine-aldostérone, dont le rôle principal est le contrôle de la tension artérielle.On retrouve ce site essentiellement sur des cellules du tractus respiratoire et digestif, sur certaines cellules du cœur, de la peau et du système nerveux. D’où les symptômes de la maladie les plus courants : atteinte pulmonaire, assez souvent aussi digestive et fréquemment la perte de goût et d’odorat. De plus la fixation de ce coronavirus sur le récepteur ACE2 explique en partie pourquoi l’hypertension artérielle est un facteur de risque aggravant.
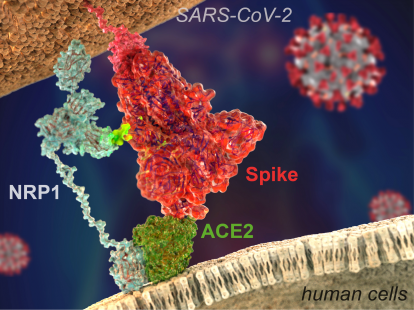 Ainsi fixé par son spicule à la cellule hôte sur le site ACE2, le virus ne peut pas encore pénétrer dans celle-ci. En effet à ce moment la protéine S est en conformation de « pré-fusion ». Pour pénétrer dans la cellule cette protéine S doit subir un clivage et acquérir sa conformation de « post-fusion ». Ce clivage va se produire grâce à la furine, cette enzyme capable de séparer deux sites (S1 et S2) du spicule et lui permettant ainsi d’activer sa conformation de fusion.
Ainsi fixé par son spicule à la cellule hôte sur le site ACE2, le virus ne peut pas encore pénétrer dans celle-ci. En effet à ce moment la protéine S est en conformation de « pré-fusion ». Pour pénétrer dans la cellule cette protéine S doit subir un clivage et acquérir sa conformation de « post-fusion ». Ce clivage va se produire grâce à la furine, cette enzyme capable de séparer deux sites (S1 et S2) du spicule et lui permettant ainsi d’activer sa conformation de fusion.LE SITE DE CLIVAGE DE LA PROTEINE S
Le séquençage du sars-cov2 et l’ingénierie moléculaire ont permis d’établir que le site de clivage du spicule est situé entre deux sites nommés S1 et S2 – leur désunion permettant au spicule d’acquérir sa conformation de fusion-, eux-mêmes jouxtant un autre site important appelé RBD. C’est précisément ce site RBD de la protéine spike qui est majoritairement victime de mutations.
L’apparition de ce site de clivage furine est un élément intéressant pour l’étude phylogénétique du sars-cov2 pouvant expliquer en particulier le franchissement de la barrière d’espèce et son pouvoir infectieux pour l’homme.
LA PRESENCE D’UN SITE FURINE SUR UNE PROTEINE DE SPICULE EST CONSIDEREE PAR LES VIROLOGUES COMME UNE PROPRIETE FACILITANTE DE L’INFECTIOSITE DES CORONAVIRUS.
Références :
https://fr.wikipedia.org/wiki/Furine
http://www.cnrs.fr/fr/le-sequencage-du-nouveau-coronavirus-revele-une-subtile-difference-avec-le-sras
https://www.medecinesciences.org/en/articles/medsci/full_html/2020/07/msc200195/msc200195.html
https://www.youtube.com/watch?v=yvk60TvXu_8
https://fr.wikipedia.org/wiki/Enzyme_de_conversion_de_l%27angiotensine_2
https://www.inrae.fr/actualites/analyse-proteine-qui-permet-au-sars-cov-2-dinfecter-cellules
-